电话举报:0591-38265150
邮件举报:cosunterjb@163.com
信件举报:福建省福州高新区乌龙江中大道7号创新园二期16号楼,邮政编码:350003,收件人:监察负责人
乙型肝炎病毒(HBV)感染常导致肝硬化和肝细胞癌,是引起进行性肝脏疾病的主要病因。遗传特征研究发现,HBV的复制周期特异性地依赖于宿主物种类型及其肝细胞。尽管用克隆的病毒基因组转染肝肿瘤来源的细胞系后可实现HBV复制和病毒颗粒组装,然而只有在人原代肝细胞(PHH)或树鼩原代肝细胞内才能获得完整的全病毒复制周期,包括通过受体介导的病毒穿入、将核壳体转送至细胞核、rcDNA修复和cccDNA的形成。直到2002年Gripon等先获得HBV易感细胞系,他们从一名HCV感染患者的肝脏中培养出肝祖细胞系(HepaRG),再经特定的培养条件分化后获得HBV的易感性。该培养条件包括一个为期四周的分化过程,终获得胆管样细胞和肝样细胞(HLC)。后者和PHH相似,表达肝细胞特异的标记物,如细胞色素P450和人白蛋白等。HepaRG细胞分化后对HBV具有易感性,说明分化的细胞表达了HBV受体,但当时并不清楚HBV受体是什么。十年之后,北京的李文辉小组发现钠-牛磺胆酸盐共转运多肽(NTCP)正是长期以来一直在探索的HBV受体,HepaRG细胞分化后也确实诱导了NTCP的表达。
另一条探索获得HBV易感细胞系的途径是对不同来源的干细胞进行分化,从而获得HLC,如人类胚胎干细胞(hESC)、肝祖细胞和骨髓间充质干细胞等。利用hESC获得HLC的方案通常包括三个关键步骤:(1)诱导内胚层的生成,(2)肝细胞定向分化,(3)肝细胞成熟。2006年,Yamanaka及其同事通过将Oct3/4、Sox2、c-Myc以及Klf4这四个转录因子导入小鼠成纤维细胞而获得了多能干细胞,这些重编程的诱导性多能干细胞(iPSC)可以分化为HLC。随后出现了很多的优化方案,这些方案均遵循一些相似的原则。简而言之,先通过激活素A和Wnt3a来诱导生成内胚层,这一过程可通过免疫荧光法(IF)检测转录因子SOX17、FOXA2和GATA4进行评估;其次,通过成纤维细胞生长因子或化学制剂二甲基亚砜(DMSO)来诱导肝母细胞的形成,后者也可用于诱导HepaRG细胞的易感性,这一过程通过肝细胞核因子4(HNF4α)、细胞角蛋白19(CK19)、甲胎蛋白(AFP)和上皮细胞粘附分子(EPCAM)的表达进行监测;后,在含有肝细胞生长因子和抑瘤素M的培养条件下将肝母细胞向成熟肝细胞分化,该过程往往伴有脱唾液酸糖蛋白受体(ASGR)、白蛋白、细胞角蛋白18(CK18)和CYP3A4的表达。成熟HLC还具备尿素生成、吲哚菁绿(ICG)摄取和糖原存储等肝细胞功能。此外,将HLC移植入动物模型后可促进肝功能的恢复。目前没有将HBV的易感性作为评价HLC功能的标准。
在之前进行的一项研究中,Shlomai等次证明HBV可以感染iPSC来源的HLC。该研究表明,在肝细胞成熟过程中,存在明显诱导的NTCP表达,从而获得对HBV的易感性,提示人iPSC来源的HLC可以应用于HBV生物学研究。重要的是,该研究为从某些患者群体以及具有某种遗传多态性的个体中获得具有HBV易感性的细胞提供了研究方向。
美国国立卫生研究院的Jake Liang 等利用人ESC来源和人iPSC来源的HLC建立了有效可控的HBV体外模型,证实和拓展了上述发现。该小组利用他们之前建立的分化方案,在重编程的过程中对已知的肝细胞标记物,如维甲酸X受体(RXR)、HNF4α和NTCP受体的表达进行动态分析,发现所有相关标记物都存在诱导性表达。而且,与PHH和HepaRG细胞相比,干细胞来源的HLC中诱导性NTCP表达水平更高。此外,在对PHH进行单层细胞培养时其NTCP迅速消失,而干细胞来源的HLC中NTCP的存在时间更长。这一发现尤其重要,因为这是长期培养时病毒可以进行传播的先决条件。研究人员还确认在HBV感染后,观察到cccDNA生成、病毒RNA表达、HBsAg和HBeAg分泌以及病毒增殖等。根据细胞内HBsAg染色结果,当使用300基因组当量(mge)HBV时,约30%的干细胞来源的HLC可被病毒感染。与之前观察到的PHH和HepaRG细胞以及表达NTCP的HepG2-NTCP相比,这种感染率颇为“低效”。然而,当病毒负荷增加至1000 mge时,细胞感染率几乎增加至100%。这一表现与PHH相似,且所有HLC亚群均有易感性。然而,HepaRG细胞在分化后有50%为不具有易感性的胆管细胞,且只有一个肝细胞亚群可被感染。因此,.0需要较高的病毒负荷来获得高乙型肝炎病毒感染率未必是某一特定体外感染系统的缺陷,可能在一个扩散速度有限的二维细胞培养系统中,将病毒从未成熟的形式转化为可以结合NTCP的形式是一个较慢的过程(见表1)。
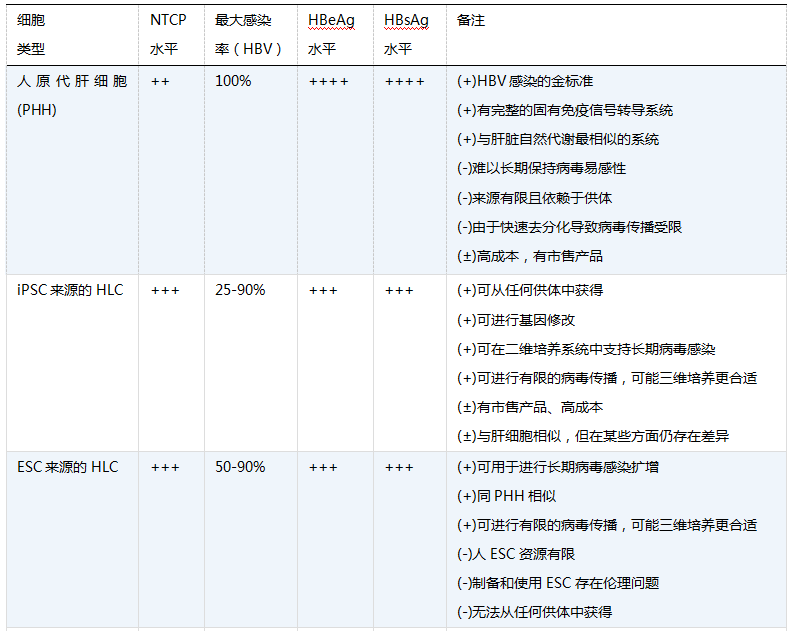
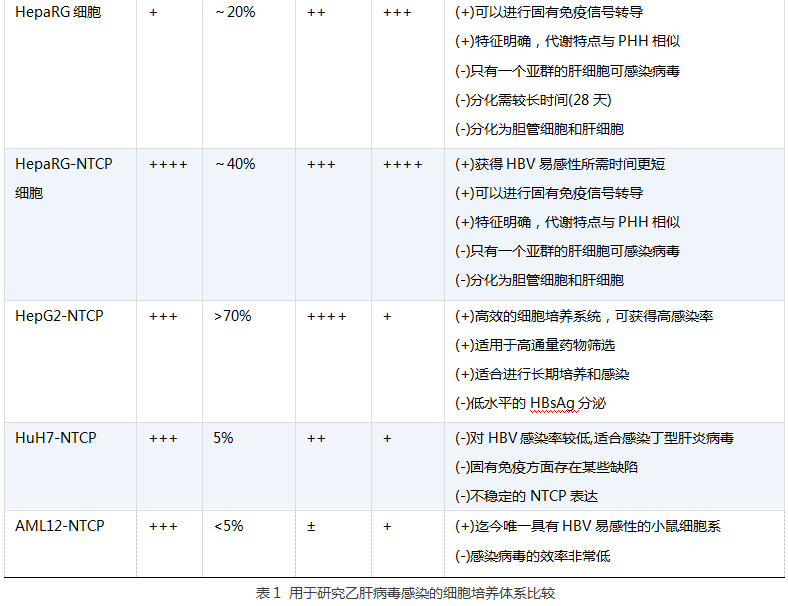
+号数代表抗原水平:++++,非常高;+++,高;++,中等;+,低;±,非常低。
评价栏:(+)和(-)分别代表正面和负面评价,(±)代表中立
Ni Y等一个重要发现是在终分化完成后HLC的易感性可持续达4周,这和PHH形成鲜明的对比。这一发现鼓励了作者继续研究如果培养时间足够长,允许HBV在感染后进行多个周期的增殖,HLC是否可支持子代病毒的传播。HBV病毒包膜源性抑制剂myrcludex B可干扰NTCP介导的HBV感染,作者通过长期使用该抑制剂证实当病毒侵入肝细胞的通路被阻塞后,该培养体系中病毒标记物水平会显著降低。此外,他们还采用免疫化学方法证实抑制剂可阻止邻近感染细胞群的形成。目前尚未在其它细胞培养系统中发现类似结果,该发现与移植PHH的uPA/SCID小鼠体内试验数据一致。值得注意的是,在培养系统内这种低水平的病毒传播仍不足以达到对导入病毒进行净扩增的要求。这与鸭HBV感染模型的结果明显不同,在鸭原代肝细胞中可观察到病毒净扩增。这可能反映了两种病毒的侵入通路有明显差别。因此,在未来的研究中很有必要将HLC置于三维培养环境中来观察病毒传播的水平是否增加。
为评估HLC是否适用于研究病毒-宿主相互作用以及药物筛选,作者用siRNA先后沉默两个已知的宿主因素NTCP和APOBEC3B,发现沉默关键宿主依赖因子NTCP使细胞易感性降低了2倍,而沉默宿主抑制因子APOBEC3B使HBV复制增加了约1.5倍。后,作者对HLC是否适合用于高通量药物筛选进行了研究,终筛出两个潜在的抗病毒药物,染料木黄酮和RXR拮抗剂PA452。
以上对hiPSC或hESC来源的HLC进行应用探索,为未来针对HBV复制周期的研究提供了非常重要的新型工具。为了将体外培养系统改善为更类似于肝脏自然状态(类器官、三维培养、生物反应器),很重要的一个方面是通过研究HLC的应用来取代PHH,后者来源有限。后,对于直接修改干细胞系基因的研究进展将对特异性宿主因素的研究产生深远影响,如从具有已知某种多态性或遗传疾病的成人成纤维细胞中制备iPSC,将其转化为个体特异的HLC,并用于乙肝病毒研究。